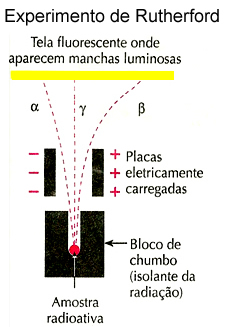
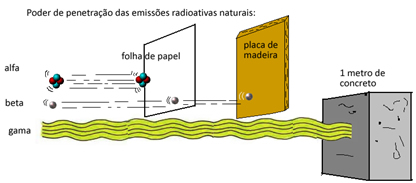
A estequiometria de uma reação química é de suma importância por informar o reagente limitante, a massa e volume (no caso de gases)
finais dos produtos, a quantidade de reagentes que deve ser adicionada
para que determinada quantidade de produto seja obtido, dentre outros
dados. Portanto, o balanceamento de equações químicas deve ser feita sempre que se deseja retirar alguma informação acerca de uma reação fornecida.
Para que o balanceamento de reações químicas seja feito de maneira correta, deve-se atentar para os seguintes princípios:
1) Lei de conservação de massa:
Essa lei indica que a soma das massas de todos os reagentes deve ser
sempre igual à soma das massas de todos os produtos (princípio de
Lavoisier).
2) Lei das proporções definidas: Os produtos de
uma reação são dotados de uma relação proporcional de massa com os
reagentes. Assim, se 12g de carbono reagem com 36g de oxigênio para
formar 48g de dióxido de carbono, 6g de carbono reagem com 18g de oxigênio para formar 24g de dióxido de carbono.
3) Proporção atômica: De maneira análoga à lei das proporções definidas, os coeficientes estequiométricos devem satisfazer as atomicidades das moléculas de ambos os lados da equação. Portanto, são necessárias 3 moléculas de oxigênio (O2) para formar 2 moléculas de ozônio (O3).
Deve-se lembrar que, de acordo com a IUPAC, os coeficientes estequiométricos devem ser os menores valores inteiros possíveis.
Métodos de Balanceamento
MÉTODO DAS TENTATIVAS
Como o nome já sugere, consiste na escolha de números arbitrários de
coeficientes estequiométricos. Assim, apesar de mais simples, pode se
tornar a forma mais trabalhosa de balancear uma equação.
MÉTODO ALGÉBRICO
Utiliza-se de um conjunto de equações, onde as variáveis são os
coeficientes estequiométricos. Sendo que, essas equações podem ser solucionadas por substituição, escalonamento ou por matrizes (através de determinantes).
Exemplo: NH4NO3 → N2O + H2O
Passo 1: Identificar os coeficientes.
aNH4NO3 → bN2O + cH2O
Passo 2: Igualar as atomicidades de cada elemento
respeitando a regra da proporção atômica. Assim, deve-se multiplicar a
atomicidade de cada elemento da molécula pelo coeficiente
estequiométrico identificado anteriormente.
Para o nitrogênio: 2a = 2b (pois existem 2 átomos de N na molécula NH4NO3)
Para o hidrogênio: 4a = 2c
Para o oxigênio: 3a = b + c
Ou seja, o número de átomos de cada elemento deve ser igual no lado dos reagentes e no lado dos produtos.
Passo 3: Resolver o sistema de equações
Se 2a = 2b, tem-se que a = b.
Se 4a = 2c, tem-se que 2a = c.
Portanto, atribuindo-se o valor arbitrário 2 para o coeficiente a, tem-se:
a = 2, b = 2, c = 4.
Mas, como os coeficientes devem ser os menores valores inteiros possíveis:
a = 1, b = 1, c = 2.
Passo 4: Substituir os valores obtidos na equação original
1NH4NO3 → 1N2O + 2H2O, ou simplesmente, NH4NO3 → N2O + 2H2O
MÉTODO REDOX
Baseia-se nas variações dos números de oxidação
dos átomos envolvidos de modo a igualar o número de elétrons cedidos
com o número de elétrons ganhos. Se no final do balanceamento redox
faltar compostos a serem balanceados, deve-se voltar para o método das
tentativas e completar com os coeficientes restantes.
Exemplo: Fe3O4 + CO → FeO + CO2
Passo 1: Identificar os átomos que sofrem oxirredução e calcular as variações dos respectivos números de oxidação.
Sabendo-se que o Nox do oxigênio é -2 para todos os compostos
envolvidos. O Nox do Ferro varia de +8/3 para +2. E, o Nox do carbono de
+2 para +4.
Portanto, o ferro se reduz e o carbono se oxida.
ΔFe = 8/3 – 2 = 2/3 (variação de Nox do ferro)
ΔC = 4 – 2 = 2 (variação de Nox do carbono)
Passo 2: Multiplicar a variação de Nox pela
respectiva atomicidade no lado dos reagentes e atribuir o valor obtido
como o coeficiente estequiométrico da espécie que sofreu processo
reverso. Assim, o número obtido pela multiplicação da variação de Nox do
ferro pela sua atomicidade deve ser atribuído como o coeficiente
estequiométrico da molécula de CO.
Para o ferro: 2/3 . 3 = 2
Para o carbono: 2 . 1 = 2
Portanto, o coeficiente do Fe3O4 é igual a 2, e o coeficiente do CO também.
2Fe3O4 + 2CO → FeO + CO2
Simplificando-se os coeficientes para os menores valores inteiros possíveis, tem-se:
Fe3O4 + CO → FeO + CO2
Passo 3: Acrescentar os coeficientes restantes
Para completar o balanceamento, pode-se realizar o mesmo procedimento
utilizado no lado dos reagentes (multiplicando a variação de Nox pela
atomicidade do elemento na molécula) ou realizar o método de tentativas.
A primeira opção é a mais viável, embora para equações mais simples
(como a indicada como exemplo) possa ser utilizado o segundo método. O
fato é que ambos os métodos devem levar à mesma resposta final.
Como a atomicidade do carbono no CO2 é igual a 1,
multiplicando-se pela variação do Nox 2, obtém-se o coeficiente 2 para o
FeO. Do mesmo modo, sendo a variação de Nox do ferro igual a 2/3,
multiplicando-se pela atomicidade 1 na molécula de FeO, obtém-se o
coeficiente 2/3 para o CO2.
Agora, basta balancear o lado dos produtos:
Fe3O4 + CO → 2FeO + 2/3CO2
Como os coeficientes devem ser os menores valores inteiros possíveis,
deve-se multiplicar a equação por 3/2 a fim de retirar o coeficiente
fracionário do CO2:
Fe3O4 + CO → 3FeO + CO2
MÉTODO ÍON-ELÉTRON
Baseia-se na divisão da reação global de oxirredução em duas
semi-equações. Sendo que, para a semi-equação de redução deve-se
acrescentar os elétrons no lado dos reagentes e o ânion no lado dos
produtos. De forma análoga, para a semi-equação de oxidação, deve-se
adicionar os elétrons no lado dos produtos junto à espécie oxidada,
enquanto que no lado de reagentes deve estar a espécie mais reduzida.
Exemplo: CuSO4 + Ni → NiSO4 + Cu
Passo 1: Identificar as espécies que sofrem oxidação e redução
No composto CuSO4, o cobre possui Nox +2 e transforma-se em cobre puro com Nox 0. Assim como, o Níquel puro passa do estado 0 para o estado de oxidação +2. Portanto, o cobre 2+ sofre redução e o níquel oxidação.
Passo 2: Escrever as semi-equações
Cu2+ + 2e → Cu
Ni → Ni2+ + 2e
Passo 3: Somar as semi-equações de modo a balanceá-las e cancelar os elétrons cedidos com os ganhos
Cu2+ + Ni → Ni2+ + Cu, ou simplesmente, CuSO4 + Ni → NiSO4 + Cu
Caso a quantidade de elétrons cedidos e ganhos não fosse igual, as
duas semi-equações deveriam ser multiplicadas por números inteiros de
modo a equilibrar as cargas.
Se a equação inicial possuir íons H+ em um dos lados ou átomos de
oxigênio, também em um dos lados, deve-se balancear a primeira espécie
com moléculas de hidrogênio e a segunda com moléculas de água.