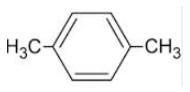
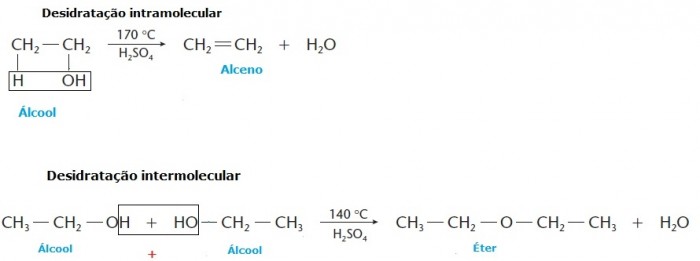
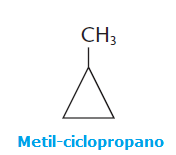
Quem nunca ouviu esta expressão: “Comprar gato por lebre”. Trata-se de
vender uma mercadoria com preço elevado, sem que a mesma tenha este
valor. E pensar que este golpe é bem antigo e já atingiu até mesmo o
ouro, um dos elementos conhecidos pelo homem desde os primórdios da
civilização (2600 a.C.).
Como é muito raro, este metal precioso já foi alvo de golpes como o do “Ouro de Tolo”. A descoberta de uma pedra muito parecida com o ouro, denominada de Pirita (FeS2), foi motivo para enganar muita gente na Antiguidade. Essa pedra é muito inferior se comparada com o ouro, mas possui semelhanças físicas como cor, brilho, e por isso se passava por ele, e o pior: era vendida como tal, daí a expressão: “Comprar gato por lebre”. Mas nada que se compare com as valiosas propriedades do ouro, como sua estabilidade que não permite ser atacado por nenhum reagente.
Para não ser enganado é preciso saber algumas propriedades do ouro, como por exemplo, a de formar ligas metálicas, veja como é possível obter os seguintes tipos de ouro com a mistura de outros metais:
Ouro branco: liga de ouro que contém 20 a 50 % de níquel.
Ouro 12 quilates: mistura de 12 gramas de ouro + 12 gramas de prata (ou cobre).
Ouro 18 quilates: mistura de 18 gramas de ouro + 6 gramas de prata (ou cobre).
As ligas garantem uma maior dureza ao material, o que torna possível a confecção de jóias como anéis, pulseiras e colares. Com o ouro 100 % puro (24 quilates), chamado de ouro nativo, não é possível obter objetos, uma vez que ele é maleável, ou seja, não possui consistência.
Se o que te preocupa é comprar o “Ouro de Tolo”, saiba que existe um teste muito rápido que permite identificar se é ouro ou pirita: a passagem de corrente elétrica permite diferenciar as espécies, ouro conduz corrente elétrica e pirita não.
Como é muito raro, este metal precioso já foi alvo de golpes como o do “Ouro de Tolo”. A descoberta de uma pedra muito parecida com o ouro, denominada de Pirita (FeS2), foi motivo para enganar muita gente na Antiguidade. Essa pedra é muito inferior se comparada com o ouro, mas possui semelhanças físicas como cor, brilho, e por isso se passava por ele, e o pior: era vendida como tal, daí a expressão: “Comprar gato por lebre”. Mas nada que se compare com as valiosas propriedades do ouro, como sua estabilidade que não permite ser atacado por nenhum reagente.
Para não ser enganado é preciso saber algumas propriedades do ouro, como por exemplo, a de formar ligas metálicas, veja como é possível obter os seguintes tipos de ouro com a mistura de outros metais:
Ouro branco: liga de ouro que contém 20 a 50 % de níquel.
Ouro 12 quilates: mistura de 12 gramas de ouro + 12 gramas de prata (ou cobre).
Ouro 18 quilates: mistura de 18 gramas de ouro + 6 gramas de prata (ou cobre).
As ligas garantem uma maior dureza ao material, o que torna possível a confecção de jóias como anéis, pulseiras e colares. Com o ouro 100 % puro (24 quilates), chamado de ouro nativo, não é possível obter objetos, uma vez que ele é maleável, ou seja, não possui consistência.
Se o que te preocupa é comprar o “Ouro de Tolo”, saiba que existe um teste muito rápido que permite identificar se é ouro ou pirita: a passagem de corrente elétrica permite diferenciar as espécies, ouro conduz corrente elétrica e pirita não.