Apesar da dificuldade em classificação de alguns materiais, pode-se
dizer que os estados físicos da matéria, ou seja, conforme as condições
em que se encontram, as substâncias podem se apresentar num dos três
estados físicos: sólido, líquido ou gasoso. Por exemplo, “os cientistas
classificam o vidro como um sólido amorfo, sem forma - algo como um
sólido quase líquido, um meio-termo entre esses dois estados físicos. É a
mesma categoria do plástico, por exemplo. A diferença principal entre a
solidez de um pote de vidro e a dos chamados sólidos perfeitos é a
organização das moléculas que compõem cada um desses objetos”1.
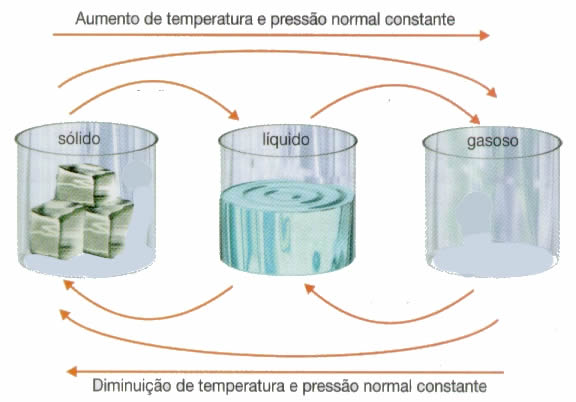
O estado sólido é caracterizado Por sua forma e volume constantes, e
maior proximidade entre suas partículas. O estado líquido apresenta
volume constante e forma variável, e maior liberdade de movimento entre
as suas partículas do que o estado sólido. Já no estado gasoso, o qual
apresenta forma e volume variáveis, as partículas estão mais afastadas
umas das outras, possuindo ampla liberdade de movimento.
Ao mencionarmos um estado físico devemos considerar sempre as
condições de temperatura e pressão, de modo que o aumento da temperatura
favorece o estado gasoso, ao passo que o aumento da pressão
irá favorecer o estado sólido. Assim, nas condições ambientes (20°C, 1
atm) a água se apresenta como um líquido, o ferro como um sólido, o
oxigênio como um gás. Variando as condições, ou seja, variando a
temperatura e/ou a pressão pode ocorrer variação do estado físico.
Desse modo, variando somente a temperatura e mantendo a pressão
constante, por exemplo, a pressão atmosférica (1 atm), para o caso da
água, do ferro e do oxigênio, temos:
| SÓLIDO | LÍQUIDO | GASOSO | |
| água | Abaixo de 0°C | Entre 0°C e 100°C | Acima de 100°C |
| ferro | Abaixo de 1500°C | Entre 1500°C e 3000°C | Acima de 3000°C |
| oxigênio | Abaixo de -210°C | Entre -183°C e -210°C | Acima de -183°C |
Dessa forma, todas as substâncias, sejam simples ou compostas, podem
se apresentar nos estados sólido, líquido ou gasoso, de acordo com
variações na temperatura e pressão. De acordo com a tabela acima, a qual
aborda apenas o fator “temperatura” por considerar todos os processos
adiabáticos (que ocorrem em pressão constante), pode-se notar as
diferenças entre os pontos de mudança de estado nos materiais
considerados, o que se deve basicamente à intensidade da forma de
interação molecular entre suas partículas constituintes. No caso, as
forças de natureza molecular, ou seja, intermoleculares, que
diferenciam-se consideravelmente daquelas de natureza intramolecular.

Nenhum comentário:
Postar um comentário