Para que uma reação química ocorra, é necessário que as espécies envolvidas (átomos, moléculas ou íons)
interajam entre si através de choques mecânicos. Assim, através dessas
colisões formam-se os complexos ativados, e posteriormente os produtos
finais.
Um complexo ativado é nada mais que o estado intermediário entre
reagentes e produtos, caracterizado pelo encontro das moléculas de
reagentes com enfraquecimento das ligações, e instantânea formação dos
produtos, com ligações sólidas. Sendo então existentes por um curtíssimo
espaço de tempo, uma vez que os choques ocorrem desordenadamente e a
reação se processa a cada momento.
Entretanto, para que um complexo ativado seja formado, é necessária
uma determinada quantidade de energia que capaz de vencer a força de
repulsão criada pela aproximação das eletrosferas das espécies, a
chamada energia de ativação. Portanto, é responsável pelas colisões e
quebra de ligações dos reagentes, podendo ser fornecida, por exemplo,
sob forma de calor.
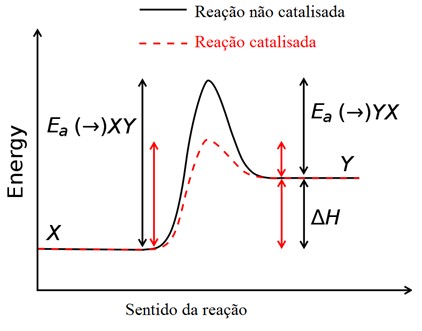 Um catalisador é capaz de criar
determinadas condições no meio (como a melhora no contato e colisões
mais efetivas ou alteração no pH) que favoreçam a reação através da
diminuição da energia de ativação, assim, o equilíbrio da reação é
atingido mais rapidamente, mas sem deslocamento. Ou seja, a mesma
quantidade de produto será obtida através de um processo sem e com
catalisador, a diferença estará apenas no tempo necessário para que tal
quantidade seja produzida.
Um catalisador é capaz de criar
determinadas condições no meio (como a melhora no contato e colisões
mais efetivas ou alteração no pH) que favoreçam a reação através da
diminuição da energia de ativação, assim, o equilíbrio da reação é
atingido mais rapidamente, mas sem deslocamento. Ou seja, a mesma
quantidade de produto será obtida através de um processo sem e com
catalisador, a diferença estará apenas no tempo necessário para que tal
quantidade seja produzida.Ação do Catalisador em uma sequência de reações
Os catalisadores podem agir como seqüestrastes de reagentes (sendo
assim o princípio dos catalisadores sólidos em meio a um leito gasoso ou
líquido), onde após os mesmos colidirem efetivamente, os produtos
gerados são liberados e um novo ciclo reagentes + catalisador → produtos
– catalisador começa.
O esquema a seguir ilustra a ação de um catalisador para a reação genérica A + B → C:
Como pode ser analisado, o reagente A une-se ao catalisador;
em seguida o reagente B segue o mesmo caminho, formando o complexo
ativado AB. Instantaneamente o produto C é formado e desprende-se do
catalisador que, agora livre,
pode novamente ligar-se aos reagentes A e B gerando o mais uma vez o
produto C. Sendo este processo contínuo até que os reagentes se esgotem
ou o catalisador seja contaminado.
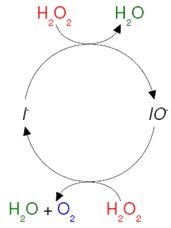
Um ciclo catalítico bastante simples é o de
decomposição do peróxido de hidrogênio (água oxigenada) em água e
oxigênio livre pela ação do íon iodeto:
Observe que o mecanismo existente é o seguinte, onde o íon iodeto sempre é recuperado ao final de cada série de reações:
H2O2(aq) + I-(aq) → OI-(aq) + H2O(l)
H2O2(aq) + OI-(aq) → I-(aq) + H2O2(l) + O2(g)


Nenhum comentário:
Postar um comentário