O diamante e o grafite são
variedades alotrópicas naturais do elemento químico carbono. Porém,
esses dois materiais possuem características e propriedades distintas,
conforme se pode ver na tabela a seguir:
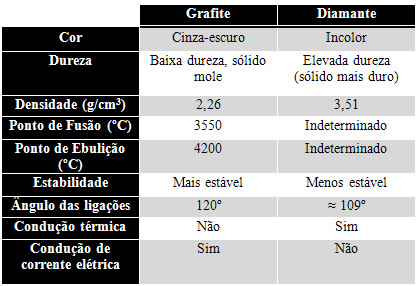
Observe que uma das diferenças mais destacadas entre o grafite e o
diamante é o fato de o grafite conduzir corrente elétrica – e até ser
usado como eletrodo em algumas reações de oxirredução, como em
eletrólises – e o diamante não. Já no que diz respeito à condução
térmica, ocorre o contrário.
Como eles podem ser tão diferentes
se ambos são feitos somente de carbono? E o que explica o fato de o
grafite conduzir corrente elétrica e o diamante não, sendo que ele
conduz calor?
A resposta está no tipo de ligação existente entre os carbonos e no arranjo cristalino dos átomos no espaço.
No caso do grafite, os átomos de carbono formam anéis hexagonais
contidos num mesmo espaço plano, formando lâminas que se mantêm juntas
por forças de atração mútua. Essas lâminas se sobrepõem umas às outras,
permitindo uma espécie de deslizamento ou deslocamento dos planos. Isso
explica por que o grafite possui pouca dureza, pois essa propriedade
facilita o desgaste do sólido. Em virtude dessa propriedade, o grafite é
usado como lubrificante em engrenagens e rolamentos. Veja a seguir a
sua estrutura:
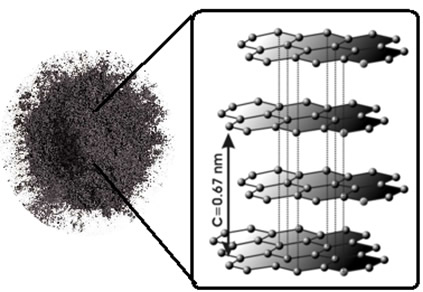
Observe os anéis hexagonais formados. Neles está a resposta de por que o grafite conduz eletricidade: nos anéis hexagonais existem duplas ligações, ou ligações pi (π), conjugadas, que permitem a migração dos elétrons. Além disso, os carbonos assumem uma hibridização sp2 (plana), formando, como já dito, folhas superpostas como "colmeias", isto é, que estão paralelas; e ligações
em planos diferentes, que são mais fracas, permitindo a movimentação de
elétrons entre os planos, ou seja, ocorre a transferência da
eletricidade.
Já no caso do diamante, cada átomo de carbono está ligado a outros
quatro átomos desse mesmo elemento químico, não contidos em um mesmo
plano:
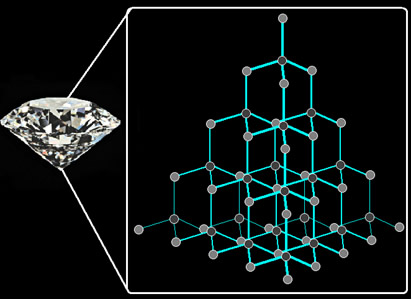
Observe que o diamante não possui ligações duplas, mas os seus carbonos possuem hibridização sp3
(tetraédrica), portanto seus cristais são arranjos desses tetraedros,
cuja conformação atômica dificulta o trânsito dos elétrons de modo
linear e, portanto, torna o diamante um mau condutor de eletricidade.
Outro ponto é que, visto que o diamante tem uma estrutura com poucas
falhas e muito bem "amarrada", por assim dizer, ele conduz a energia
cinética – expressa pelo calor – com uma velocidade muito alta; por
isso, ele é um bom condutor térmico e mau condutor elétrico.

Nenhum comentário:
Postar um comentário